Зверев В.О., врач-педиатр ГКУ ЦСПР «Дом Детей», Москва
Аннотация.В статье дается обзор современных данных о роли витамина D в здоровье детей, а также подробно рассматривается влияние витамина D на иммунитет.
Ключевые слова. Витамин D, обмен веществ, иммунитет.
Считается, что дефицит витамина D широко распространен во всем мире, что является следствием урбанизации и изменения образа жизни с продолжительном нахождением в помещении. А также, возможно, связано со стратегией ВОЗ для снижения роста заболеваемости раком кожи и уменьшения солнечной активности, снижение времени нахождения под солнцем.
За последние 10―15 лет повышенный риск широкого спектра заболеваний был связан с дефицитом витамина D, хотя во многих случаях это остается недоказанным. Уже давно известно, участие нормального уровня витамина D в регуляции здоровья костей. Дефицит же связывают с развитием расстройств иммунитета. Давайте рассмотрим некоторые свидетельства доказывающие или опровергающие факты о дефиците витамина D3.
Эпидемиология
Признаки того, что витамин D может быть связан с нарушениями иммунной системы человека, исходят из наблюдений за географической распространенностью заболеваний. Витамин D в первую очередь синтезируется в коже после воздействия солнца (в частности, облучения ультрафиолетом типа В, средневолновым). Уровни УФ-В излучения сильно различаются в зависимости от расстояния от экватора (широты) и времени года. Причем оно зависит от длительности светового дня, т.е. ближе к экватору, в дневное время и весенне-летний период его максимально полезное действие на выработку витамина D3.
Таким образом, более высокая широта часто рассматривается как показатель низких уровней ультрафиолетового излучения (УФР), так и более низкого концентрации витамина D.
Значения широты при которых распространенность заболеваний увеличивается с увеличением расстояния от экватора (более низкое УФ-B-излучение), описаны для рассеянного склероза, диабета 1 типа, аутоиммунных васкулитов, воспалительных заболеваний кишечника и астма. И ультрафиолетовое излучение, и витамин D (в его активной форме 1,25 (OH)2D, (рис. 1) обладают иммуномодулирующим действием, что, вероятно, обеспечивает механизм, при помощи которого высокие уровни витамина D могут снизить риск развития аутоиммунных заболеваний и тем же путем уменьшить возникновение инфекции или улучшить эффект после вакцинации. Так, например, эффективность вакцинации БЦЖ (от туберкулеза), возрастает с увеличением широты в связи с увеличенным ультрафиолетовым излучением.
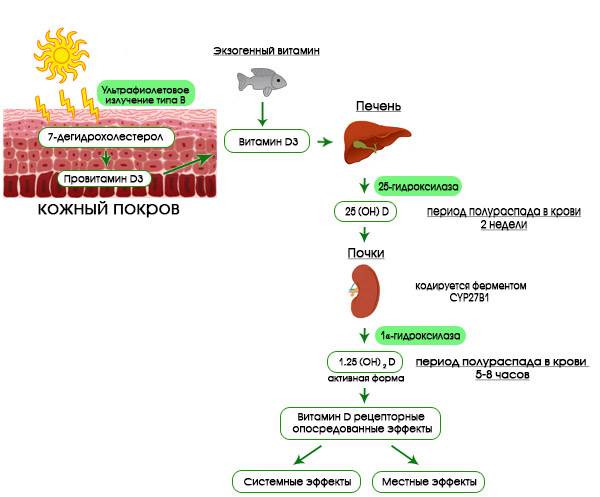
Рис. 1. Синтез витамина D после облучения кожи ультрафиолетом типа В
Фотоны UVB поглощаются 7-дегидрохолестролом в эпидермисе и превращаются в провитамин D, который подвергается термической изомеризации с образованием витамина D. Затем он претерпевает две реакции гидроксилирования, сначала в печени с образованием 25-гидроксивитамина D (25(OH)D), а затем в почках с образованием активного метаболита 1,25-дигидроксивитамина D (1,25(OH)2D). Уровни 25(OH)D в сыворотке крови используются для определения статуса витамина D. VDR-рецептор витамина D.
Многочисленные исследования в целом подтвердили эти экологические закономерности. В этих исследованиях участники с аутоиммунными заболеваниями, как правило, сообщили о низком воздействии солнца в прошлом и/или имели низкие показатели витамина D (измерялась концентрация в крови промежуточного метаболита 25(ОН)D относительно нормальных показателей.
Однако, для некоторых заболеваний трудно определить связь с недостаточным пребыванием на солнце или низким содержанием витамина D. Меньшее количество доказательств из проспективных когортных исследований, потому что эти заболевания связаны с иммунной дисфункцией, встречаются редко и требуется, чтобы большее количество участников находилось под наблюдением в течение длительного времени для достаточной выборки. В более надежных исследованиях на выявление причинно-следственной связи установлено, что низкий уровень витамина D3 предшествуют появлению нарушений здоровья. Так, низкие уровни витамина D связаны с повышенным риском развития рассеянного склероза и диабета 1 типа, хотя не все исследования доказывают эту связь.
Несмотря на эти результаты экологических и наблюдательных исследований, а также правдоподобные биологические механизмы действия, испытания добавок витамина D для профилактики заболеваний, в основном, не дали результатов. Проблемы настоящих исследований по профилактике этих заболеваний состояли в том, что болезни с длинными субклиническими фазами, с неизвестным оптимальным временем для начала лечения, помимо прочих трудностей в оценке эффектов.
На сегодняшний день профилактические испытания были сосредоточены на группах высокого риска, в которых заболевание вот-вот начнется, или на замедление развития у тех, у кого уже появилось заболевание, а там могут действовать различные факторы. Тем не менее, в этих исследованиях пока нет убедительных доказательств того, что добавление витамина D облегчает любое заболевание, связанное с иммунитетом.
Механизмы регуляции иммунных клеток витамином D3
Считается, что все типы иммунных клеток реагируют на воздействие 1,25(OH)2D. Это убеждение вызвано изучением клеточной экспрессии рецептора витамина D(VDR), обнаружением множественных первичных 1,25(OH)2D генов-мишеней в иммунных клетках и открытие, что многие иммунные клетки (макрофаги, дендритные клетки, Т- и В-лимфоциты) могут преобразовывать 25(OH)D в активный 1,25(OH)2D через фермент CYP27B1 и, следовательно, обеспечивают значительные местные клеточные концентрации 1,25(OH)2D для дальнейших функциональных процессов.
Количество продуцируемого 1,25(OH)2D может зависеть от способности иммунных клеток экспрессировать CYP27B1 и другие ферментативные механизмы пути витамина D, включая фермент дезактивации CYP24A1.
Например, макрофаги, стимулированные in vitro, продуцировали больше 1,25(OH)2D, чем дендритные клетки, которые экспрессировали укороченные транскрипты CYP27B1, приводящие к более низким уровням белка CYP27B1, а также экспрессировали повышенные уровни мРНК CYP24A1.
Несмотря на то, что исследования in vitro сообщают о значительном биологическом воздействии 1,25 (OH)2D на иммунные клетки (чаще всего в идеальных условиях с использованием потенциально превышающих физиологические концентраций 1,25(OH)2D), остается вопрос о реальных биологических эффектах. эффекты 1,25(OH)2D in vivo. Проблема еще больше усложняется тем фактом, что человеческие клетки часто используются для исследований in vitro, но большинство исследований, сообщающих о положительных биологических эффектах 1,25(OH)2D in vivo, были выполнены на экспериментальных мышах.
Существуют также различия между регуляторным потенциалом введенных (повышенных) доз по сравнению с гомеостатическими концентрациями 1,25(OH)2D. Крайние значения наблюдаются у мышей, не экспрессирующих VDR, они обладают повышенной чувствительностью к аутоиммунным заболеваниям, но это открытие дает мало информации о том, насколько 1,25(OH)2D может дозозависимо регулировать клетки, экспрессирующие VDR. Необходимы дальнейшие исследования, чтобы лучше понять регуляторные механизмы 1,25(OH)2D, потому что, многие результаты in vitro не были воспроизведены in vivo. Основная концепция заключается в том, что 1,25(OH)2D стимулирует врожденный иммунитет и подавляет адаптивный иммунитет, но механизмы, с помощью которых достигаются эти результаты, варьируются в зависимости от различных экспериментальных моделей.
Воздействие 1,25(OH)2D на дифференцирующиеся дендритные клетки предотвращает их полное созревание. Однако, остаются дебаты вокруг свойств этих «толерогенных» дендритных клеток и их способности вмешиваться в деление T-клеток и стимулирование пролиферации и размножения T-регуляторных клеток (T Reg). Некоторые исследования предполагают, что существует взаимодействие CD25, Foxp3 и T Reg клеток к пролиферации, а не развитие T Reg клеток, происходящее за счет мутации denovo. Другие исследователи сообщают, что, хотя для индукции популяций Foxp3 и T Reg требуются высокие нефизиологические концентрации 1,25 (OH) 2 D (10―6 M) и длительные периоды культивирования (около 2 недели), частоту активации in vitro Foxp3 и T Regs можно увеличить путем добавления в клетки TGF-β (2 нг/мл) и более низких концентраций 1,25 (OH)2D (10―7 M).
При введении 1,25(OH)2D in vivo свойства экспонированных дендритных клеток меняются. В одном исследовании 1,25(OH)2D наносили местно на кожу мышей. Через 18 ч, период после которого дендритные клетки должны были бы мигрировать к лимфатическим узлам, способность этих клеток к поглощению, обработке и представлению антигена совместно культивированным Т-клеткам не изменялась. Однако при переносе новому поколению мышей эти дендритные клетки вызывали значительно меньшие воспалительные реакции, что является показателем контактной гиперчувствительности. Дендритные клетки мышей, обработанных местным 1,25(OH)2D, экспрессировали повышенные уровни индоламин-2,3-диоксигеназы, что может объяснять это измененное свойство дендритных клеток in vivo. Т-клетки также могут напрямую отвечать на 1,25(ОН)2D. Наивные Т-клетки экспрессируют низкие уровни VDR, которые активируются антиген-специфическим запуском Т-клеточных рецепторов и вносят вклад в праймирование наивных клеток.
Поскольку экспрессия VDR может также ингибировать транскрипцию гена интерлейкина (IL)-2, это может представлять собой еще одну точку иммунной регуляции с помощью 1,25(OH)2D. Т-клеточные рецепторы могут быть изменены с помощью воздействия 1,25(OH)2 D и недавний анализ введения через желудочный зонд мышам, иммунизированным гликопротеином миелиновых олигодендроцитов, на индукцию экспериментального аутоиммунного энцефаломиелита, предполагает, что это может быть одной из наиболее важных иммунорегуляторных ролей витамина D3.
Авторы исследования обнаружили, что кальциферол предотвращает накопление воспалительных клеток в центральной нервной системе, хотя 1,25(OH)2D и не влияет на активацию патогенного интерферона-γ и продуцирующего IL-17 в лимфатических узлах, селезенке или участке иммунизации, то есть системная иммунная реакция на гликопротеин олигодендроцитов миелина не изменилась. Не было индукции Foxp3 и T Reg за счет взаимодействия с витамином D.
Более детально, 1,25(OH)2D, поддерживал активированные клетки Th1/Th17 в кровообращении и не позволял им пересекать гематоэнцефалический барьер. Предложенный механизм заключался в значительном и обратимом снижении экспрессии хемокинового рецептора, CXCR3. Также сообщалось о модуляции других хемокиновых рецепторов на Т-клетках с помощью 1,25(OH)2D. Кроме того, 1,25(OH)2D может снижать миграцию макрофагов путем подавления экспрессии CCR2, рецептора хемотаксического белка моноцитов-1, главным образом за счет снижения стресса эндоплазматического ретикулума.
T Regs также бывают непосредственными мишенями для активной формы витамина D. При местной введении кальциферола усиливается способность CD4, CD25 клеток в лимфатических узлах, находящихся в коже, подавлять аллергические реакции (астматические проявления), обусловленных Т-хелперами 2-го типа, при переносе аллерген-сенсибилизированным мышам.
Дальнейшие исследования показали, что 1,25(OH)2D в присутствии IL-2 непосредственно усиливает регуляторный потенциал CD4 + CD25 + T-клеток по контролю иммунных ответов.
Уровни циркуляции 1,25 (OH) 2 D в логарифм ниже, чем уровни 25(OH)D, и недостаточны для иммунорегуляции. Предполагается, что 25(OH)Dлокально превращается до достаточного уровня формы 1,25(OH)2D, для достижения биологической активности.
Недавно были идентифицированы тучные клетки с макрофагами, дендритными клетками и T- и B-лимфоцитами, которые экспрессируют CYP27B1 для местной продукции 1,25(OH)2D. Однако уровень связывающего витамин D белка и его сродство к 25(OH)Dтакже может ограничивать доступность 25(OH)D для дендритных клеток. Были изучены клетки от людей с различными вариантами витамин D-связывающего белка (VDBP), а для людей с сильным вариантом связывания 25(OH)D доступность его для дендритных клеток была ограничена, что приводило к уменьшению количества дендритных клеток и ослаблению Т-клеточного взаимодействия. Таким образом, еще многое предстоит узнать о механизмах, с помощью которых 1,25(OH)2D может регулировать активность иммунных клеток in vivo .
Рассеянный склероз
Одним из первых указаний на связь между витамином D и нарушениями иммунной функции человека были показаны в географической распространенности рассеянного склероза, впервые описанные в 1922 г. Дополнительные исследования, с тех пор, подтвердили связь широты с более высокой частотой или распространенностью в местах, удаленных от экватора, как в северном, так и в южном полушариях. Основываясь на этих экологических исследованиях, наблюдательные проверки подтвердили повышенный риск рассеянного склероза в связи с более низким уровнем пребывания на солнце и более низким уровнем 25(OH)D. Тем не менее, несмотря на правдоподобные иммунологические механизмы, посредством которых витамин D (за счет стимуляции T Reg и ослабления гиперреактивности T-хелперов 1 типа) может снизить риск рассеянного склероза или активности заболевания, испытания добавок витамина D не показали клиническую полезность их для людей с рассеянным склерозом.
Сложно провести параллели между зависимыми от витамина D и независимыми путями воздействия солнечного света на риск заболевания. Ограниченный успех испытаний добавок витамина D предполагает, что эффекты, не зависящие от витамина D, могут в большей степени способствовать риску заболевания.
У мышей начало экспериментального аутоиммунного энцефаломиелита, модели рассеянного склероза, значительно задерживалось после хронического облучения субэритемными дозами УФ-В излучения. Уровни 25(OH)D в сыворотке были лишь незначительно повышены, и уменьшения проявлений заболевания не происходило после перорального приема 25(OH)D. Однако когда 1,25(OH)2D вводили (с пищей), он подавлял развитие экспериментального аутоиммунного энцефаломиелита, но только при введении в дозах, вызывающих гиперкальциемию, поэтому одна из гипотез заключалась в том, что гиперкальциемия сама по себе важна для подавления болезни.
Т-Reg индуцирующие толерогенные дендритные клетки, индуцированные ультрафиолетовым облучением кожи, необходимы для улучшения экспериментального аутоиммунного энцефаломиелита. Было показано, что концентрации 25(OH)D в сыворотке и воздействие солнца независимо связаны с началом демиелинизации центральной нервной системы у людей и поражениями головного или спинного мозга, обнаруженными с помощью магнитно-резонансной томографии у людей с рассеянным склерозом. Кроме того, хотя повышенное пребывание на солнце в детстве было обратно пропорционально связано с риском рассеянного склероза, снижение риска не происходило, в связи с приемом добавок витамина D3 в детстве.
Нахождение на солнце в детстве может быть более значительным фактором риска для развития заболевания, чем пребывание на солнце во взрослом возрасте. На основании миграционных исследований риск развития рассеянного склероза мог быть определен уже в возрасте до 15 лет. Мигранты, переезжающие из страны с высокой распространенностью рассеянного склероза в страну с низкой заболеваемостью, сохраняют высокий риск развития заболевания, если миграция происходит после 15 лет, но имеют меньший риск если в новую страну они мигрируют до 15 лет.
Однако отсутствие пребывания на солнце не только в детстве может быть важным фактором риска развития рассеянного склероза. Связь между месяцем рождения и риском рассеянного склероза наблюдалась как в северном, так и в южном полушариях, что свидетельствует о важной роли пребывания на солнце во время развития ребенка в утробе матери для риска появления болезни в более позднем возрасте. В экспериментальной модели аутоиммунного энцефаломиелита на животных добавление витамина D в послеродовой период задерживает начало заболевания, но нет никаких доказательств того, что антенатальное добавление витамина D имеет какой-либо эффект. Хотя уровни витамина D в детском возрасте и пребывание на солнце, по-видимому, являются важными детерминантами риска начала заболевания, более высокие уровни 25 (OH)D на ранних этапах течения заболевания могут предсказать скорость прогрессирования рассеянного склероза.
Косвенный путь: витамин D, иммунитет и микробиом
После взаимодействия с патогенами иммунные клетки, такие как моноциты, синтезируют 1,25(OH)2D, средствами активации специализированных иммунных рецепторов, таких как toll-подобные рецепторы, или после стимуляции другими иммуномодуляторами, такими как TGF-β или интерферон-γ. Это стимулирует аутофагию (уничтожение дефектных и пораженных клеток или частей клеток) и синтез антимикробных агентов, таких как кателицидин (эндогенный антимикробный агент), для уничтожения бактерий.
Антимикробные белки экспрессируются на всех эпителиальных тканях, включая кишечник, кожу, мочевыводящие пути и легкие. Кателицидины нацелены на грамположительные и отрицательные бактерии, вирусы и грибы при помощи разрушения мембран и экспрессируются нейтрофилами, макрофагами, естественными клетками-киллерами, тучными клетками и эпителиальными клетками. Транскрипция CAMP гена, кодирующего кателицидин, регулируется рецептором витамина D через 1,25(OH)2D у людей, но не у грызунов. Эндогенные противомикробные пептиды, такие как кателицидин и β-дефензины, также могут действовать как иммуномодуляторы. Этот путь (рис. 2) может зависеть от уровней циркулирующего 25(OH)D, субстрата для 1,25(OH)2D, или CYP27B1, фермента, контролирующего эту реакцию, однако, доказательства этого in vivo отсутствуют.
Витамин D увеличивает в сыворотке крови уровни 25(OH)D и кателицидина, предполагается, что возможно системное воздействие на элиминацию патогенных микроорганизмов, но испытания добавок содержащих кальциферол, направленных на ускорение уничтожения Mycobacterium tuberculosis, не увенчались успехом. Бактериальные мишени витамина D in vitro включают M. tuberculosis, Pseudomonas aeruginosa и другие виды, и сообщается о преимуществах витамина D для борьбы с вирусными или грибковыми инфекциями, особенно с инфекциями нижних дыхательных путей, такими как грипп A.
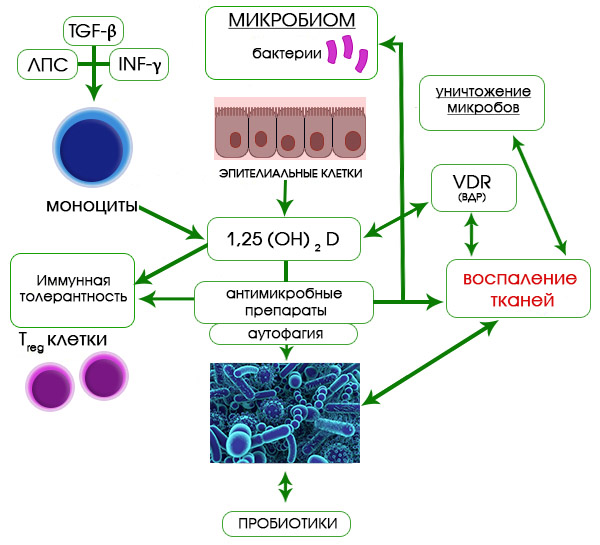
Рис. 2.Взаимодействие между витамином D и микробиомом, влияющим на развитие иммунной толерантности или воспаление тканей
Активация иммунных клеток, таких как моноциты и эпителиальные клетки продуктами бактериального происхождения (например, липополисахаридом [ЛПС], полученным из внешней мембраны грамотрицательных бактерий) и цитокинами (трансформирующий фактор роста β [TGF-β] и интерферон-γ [IFNγ], приводит к локальному синтезу 1,25(OH)2D и иммунной толерантности за счет воздействия на клетки TReg.
1,25(OH)2D также может оказывать влияние на врожденные пути, включая синтез противомикробных препаратов и активацию аутофагии, которые вместе могут модулировать местный микробиом. Альтернативно, изменения микробиома, подобные тем, которые индуцируются после использования пробиотиков, могут регулировать реакцию иммунных клеток на витамин D за счет усиления экспрессии рецептора витамина D (VDR), тем самым уменьшая воспаление тканей.
Микробиом состоит из комменсальных бактерий, которые колонизируют различные части тела, такие как желудочно-кишечный тракт, дыхательные пути и кожу. На мышиных моделях, 1,25 (ОН) 2 D во время состояния воспаления подавляют ткани путем изменения микробиома. Дефицит витамина D увеличивал тяжесть колита и количество бактерий в толстой кишке мышей, а у мышей-самцов с аллергическим заболеванием дыхательных путей (модель аллергической астмы) дефицит витамина D увеличивал воспаление легких и количество бактерий, эти эффекты были отменены добавлением витамина D.
Другие исследования связывают витамин D с определенными изменениями в составе бактериальной микрофлоры кишечника. Отсутствие фермента 1α-гидроксилазы у CYP27B1 мышей с колитом увеличивает обсеменение Proteobacterium phylum (включая виды Helicobaceteraceae) в фекалиях. Эти наблюдения были связаны с уменьшением количества толерогенных CD103 и дендритных клеток в собственной пластинке, клеток, которые формируют представительство T Reg клеток кишечника. Обработка этих мышей 1,25(OH)2D (1,25 мкг/100 г рациона) подавляла тяжесть колита и уменьшало количество Helicobaceteraceae. Аналогичные наблюдения были сделаны на людях, в результате чего увеличение количества витамина D в рационе изменило состав фекальной микробиоты. В совокупности эти исследования показывают, что витамин D играет важную роль в регулировании микробиома легких и кишечника и связан с поддержанием иммунной толерантности.
Исследования на мышах в кишечнике и легких показали, что взаимодействие между витамином D, микробиомом и иммунной толерантностью также может сдерживать воспаление кожи. Патологические микробиомы были обнаружены в пораженной коже, включая псориатические бляшки и атопический дерматит. Местные формы препаратов с1,25(OH)2D или аналоги используются для лечения псориаза и могут быть полезны для лечения атопического дерматита и других воспалительных заболеваний кожи.
Механизмы, с помощью которых 1,25(OH)2D подавляет воспаление кожи, частично связаны с стимулированием иммунной толерантности с активацией Тregs. Также при псориазе кателицидины накапливаются в дерме, которые могут иметь провоспалительные эффекты при высоких концентрациях. Другие исследования показывают, что микробиом может изменять способность тканевой регуляции с помощью кальцеферола. В моделях на грызунах пробиотики могут активировать экспрессию VDR в толстой кишке, уменьшая воспаление и задерживая переход к дисплазии и раку. Кроме того, добавка витамина D может подавлять развитие опухолей кишечника у восприимчивых мышей. В клинических условиях экспрессия VDR была снижена у пациентов с дисплазией и колоректальным раком, связанным с колитом, что позволяет предположить, что воспаление также может подавлять VDR. Эти данные предполагают, что витамин D может не только модулировать воспаление ткани посредствам модификации микробиома, но также возможно и обратное ― микробиом и воспаление могут изменять чувствительность тканей к витамину D средствами регуляции VDR. 1,25(OH)2D также активирует VDR, поэтому предполагается, что эту пониженную реакцию можно обратить с помощью витамин D3 содержащих добавок.
Почему добавки с витамином D не снижает риск заболеваний?
Для ответа на этот вопрос был предложен широкий спектр ответов с особым упором на обратную связь. Первоначально высказано предположение, что воспаление вызывает снижение уровня кальциферола, и это объясняет связь между низкими уровнями 25(OH)D и повышенным риском развития заболеваний. Для доказательств, полученных в результате исследований «случай-контроль», когда заболевание уже произошло в этих случаях, это, безусловно, выглядит правдоподобно.
Однако в опубликованных когортных исследованиях, которые показывают связь между низким уровнем кальциферола и развитием заболевания, последнее часто происходит через много лет после взятия пробы крови. Кроме всего прочего, в отношении способности дополнительного введения витамина D изменять течение аутоиммунных заболеваний ведутся споры о достоверности биохимических или клеточных маркеров крови как истинно репрезентативных для изучения статуса заболевания. Есть несколько других возможных объяснений, которые необходимо рассмотреть, и каждое из них имеет важное значение для исследователей и клинической практики.
Независимые благотворные эффекты пребывания на солнце
Воздействие ультрафиолетового излучения и 1,25(ОН)2D вызывает подавление иммунитета, которое имеет отношение к некоторым (Th-1) аутоиммунным заболеваниям. Низкие уровни 25(OH)2D, обнаруженные в обсервационных исследованиях, являются маркером снижения солнечного воздействия, причем последнее также важно для снижения риска заболеваний. Исследования добавок с витамином D, учитывают лишь сам витамин D, без учета преимущества ультрафиолетового излучения, то есть воздействия солнца.
Важность возрастного периода
Есть некоторые данные, подтверждающие важность воздействия витамина D в раннем возрасте для риска аутоиммунных заболеваний, но достоверно сложно оценить эти взаимодействия. Однако несколько исследований показывают, что низкий уровень витамина D или низкие уровни взаимодействия ультрафиолетового излучения в окружающей среде во внутриутробный период или в детстве связаны с повышенной опасностью иммунных расстройств. Отсутствие какого-либо защитного эффекта от приема добавок витамина D в зрелом возрасте может быть связано с тем, что процессы, необходимые для развития болезни, уже были запущены намного раньше в жизни.
Генетическая изменчивость физиологической реакции на добавление витамина D
Была описана высокая степень индивидуальной вариабельности реакции 25(OH)D на добавление витамина D, которая является результатом взаимодействия различных демографических, экологических и генетических факторов. Влияние этих факторов на физиологический или связанный с заболеванием ответ на добавление витамина D не изучалось.
Разобщение системы витамина D заболеванием
Неправильная работа системы витамина D может возникнуть во время протекания некоторых патологических процессов. Для примера, Mycobacterium leprae, вызывающая лепру, препятствует использованию клеточных мРНК для разобщения процессов производства антимикробных агентов индуцированных кальциферолом. Кроме того, при некоторых гранулематозных заболеваниях, таких как саркоидоз, CYP27B1 чрезмерно экспрессируется в активированных болезнью макрофагах, вызывая высокие уровни 1,25 (OH)2D, тем самым повышает риск гиперкальциемии.
Свободный и общий кальциферол в сыворотке крови
Метаболиты витамина D в крови в значительной степени тесно связаны с VDBP (витамин D-связывающий белок), при этом небольшая часть общей концентрации слабо связана с альбумином или свободна. Традиционно считалось, что уровень общего кальциферола в сыворотке служит лучшей оценкой статуса витамина D, но недавние исследования показали, что «биодоступная» (связанная с альбумином и свободная) концентрация 25(OH)D может иметь большее значение для здоровья и риска развития заболеваний. Отношение общего витамина D к биодоступному зависит от нескольких генов, связанных с VDBP, и состоянием здоровья, или его изменений, таких как заболевания печени, диабет 1 типа или беременность.
Сравнение разных форм витамина D
Существуют смешанные данные о разной физиологической активности витамина D3 по сравнению с D2. В большинстве наблюдательных исследований, в которых отдельно количественно определялись 25(OH)D2 и 25(OH)D3, уровни первого обычно низкие или неопределяемые. В самых последних исследованиях препаратов витамина D используется витамин D3, что позволяет предположить, что любые различия между D2 и D3 не объясняют разные результаты наблюдательных исследований и испытаний добавок витамина D.
Активная форма кальциферола редко используется в испытаниях добавок. Он имеет короткий период полураспада в крови, может вызывать гиперкальциемию, а повышение уровня 1,25(OH)2D в крови инициирует его дезактивацию ферментом 24-гидрокслазой.
У участников исследований не было дефицита витамина D
Если существует причинно-следственная связь между витамином D и риском развития заболеваний, то повышенная опасность возникает по причине дефицита кальциферола. В исследованиях препаратов витамина D участвуют участники, у которых нормальная исходная концентрация 25(OH)D, и риск развития заболевания у которых, таким образом, вряд ли сильно изменится. Дальнейшая работа должна быть сосредоточена на исследованиях добавок, включая только людей с низким исходным уровнем кальциферола.
Риски для людей с нормальными концентрациями кальциферола
В исследовании, смертности от ХОБЛ, проведенном в секторе общей практики, наблюдалась обратная J-образная связь между уровнем 25(OH)D в сыворотке крови и смертностью от всех причин, что указывает не только на нижние, но и на верхние границы. Самый низкий риск смертности составлял 50―60 нмоль/л. Исследование не позволило сделать вывод о причинно-следственной связи.
Аналогичным образом, в одном рандомизированном контролируемом исследовании приема высоких доз витамина D был отмечен повышенный риск падений и переломов. Если участники испытаний препаратов кальциферола уже имеют адекватные его уровни в сыворотке крови на начало исследований, вполне вероятно, что существует потеря достоверности исследования и риск причинения вреда для участников. Высокие уровни 25(OH)D не поддерживаются в течение всего периода, связанного с заболеванием.
Многие заболевания, повышенная опасность которых была связана с дефицитом витамина D, развиваются в течение длительного периода времени, например, рак и сердечно-сосудистые заболевания. Тем не менее, испытания препаратов кальциферола, как правило, относительно краткосрочные, с добавлением только на 1―2 года. Это несоответствие во времени может способствовать тому, что витамин D3 не позволил снизить риск начала заболевания.
Вопрос об участии витамина D в иммунной функции до сих пор не решен: при дефиците витамина D, увеличивается риск аутоиммунных заболеваний и вирусных инфекций из-за снижения регуляции адаптивных иммунных функций, а при высоком уровне витамина D, снижается риск туберкулеза и инфекций, вызванных другими внутриклеточными бактериями, через активацию врожденного иммунитета. Эффекты чаще всего не прямые, а косвенно происходящие через изменения в микробиоме или частично опосредованные витамином D, при этом важно и воздействие ультрафиолетового излучения.
Многие из нерешенных вопросов будет трудно или невозможно решить в исследованиях на людях, например, важность выбора оптимального времени начала приема препаратов витамина D для профилактики тех или иных заболеваний, подбора оптимальной дозы. Могут потребоваться прагматические решения, такие как изменение концентраций кальциферола в общей популяции до уровня выше минимума 40―50 нмоль/л, при этом любые положительные эффекты будут очевидны только ретроспективно.
Литература
Armas L.A., Hollis B.W., Heaney R.P. Vitamin D2 is much less effective than vitamin D3 in humans. J Clin Endocrinol Metab 2004.
Gallo R.L., Hooper L.V. Epithelial antimicrobial defence of the skin and intestine. Nat Rev Immunol. 2012.
Ginde A.A., Liu M.C., Camargo C.A. Demographic differences and trends of vitamin D insufficiency in the US population, 1988―2004. Arch Intern Med. 2009.
Hart P.H., Gorman S., Finlay-Jones J.J. Modulation of the immune system by UV radiation: more than just the effects of vitamin DNat Rev Immunol. 2011.
Hewer S., Lucas R., van der Mei I., Taylor B.V. Vitamin D and multiple sclerosis. J Clin Neurosci. 2013.
Hewison M. Antibacterial effects of vitamin D. Nat Rev Endocrinol. 2011.
Kongsbak M., Levring T.B., Geisler C., von Essen M.R. The vitamin D receptor and T cell function. Front Immunol. 2013.
Kundu R., Chain B.M., Coussens A.K., Khoo B., Noursadeghi M. Regulation of CYP27B1 and CYP24A1 hydroxylases limits cell-autonomous activation of vitamin D in dendritic cells. Eur J Immunol. 2014.
Lagishetty V., Misharin A.V., Liu N.Q., Lisse T.S., Chun R.F., Ouyang Y., McLachlan S.M., Adams J.S., Hewison M. Vitamin D deficiency in mice impairs colonic antibacterial activity and predisposes to colitis. Endocrinology. 2010.
Mora J.R., Iwata M., von Andrian U.H. Vitamin effects on the immune system: vitamins A and D take centre stage. Nature reviews Immunology. 2008.
Norval M., Woods G.M. UV-induced immunosuppression and the efficacy of vaccination. Photochem Photobiol Sci. 2011.
Ralph A.P., Lucas R.M., Norval M. Vitamin D and solar ultraviolet radiation in the risk and treatment of tuberculosis. Lancet Infect Dis. 2013.
Sanders K.M., Stuart A.L., Williamson E.J., Simpson J.A., Kotowicz M.A., Young D., Nicholson G.C. Annual high-dose oral vitamin D and falls and fractures in older women: a randomized controlled trial. JAMA. 2010.
Zerwekh J.E. Blood biomarkers of vitamin D status. Am J Clin Nutr. 2008.
Zodpey S.P., Shrikhande S.N. The geographic location (latitude) of studies evaluating protective effect of BCG vaccine and it's efficacy/effectiveness against tuberculosis. Indian J Public Health. 2007.

